Mecanismos de ação hormonal e transdução de sinais:
Mecanismos
bioquímicos que a célula desencadeia em resposta a um sinalizador.

O que os sinais químicos podem produzir?
- Regulação do metabolismo
- Alterar ou manter o estado de diferenciação celular
- Influenciar no processo de proliferação celular, modulando a proliferação das células
- Indicar a morte celular
Desde o estudo da embriologia já se fala em sinalização celular. No início da formação do indivíduo, a célula ovo (zigoto) começa a se multiplicar e se diferenciar, e esses processos dependem de moléculas sinalizadoras para coordenar o processo desenvolvimento do organismo.
Existem várias formas de uma célula se comunicar com a outra. Uma dessas maneiras é através de junções comunicantes, formadas por proteínas chamadas conexinas, que são hexâmeros. Essas proteínas formam poros na membrana de células adjacentes, criando um "canal" de comunicação entre elas. É mecanismo de sinalização é muito eficiente, mas só funciona em células adjacentes, vizinhas.
Quando as células não são adjacentes/justapostas, são necessárias outras estratégias de comunicação celular entre células distantes, ou até mesmo entre células vizinhas que não sejam justapostas:
1- Liberação de mensageiros químicos de uma célula sinalizadora para o meio extracelular.
2- Transporte do mensageiro químico através do meio extracelular para a célula alvo.
3- Transmissão do sinal para a célula alvo através da ligação da molécula sinalizadora com um receptor específico.
Visão geral da sinalização celular:
- Direta: ocorre através das junções comunicantes, pelas quais o mensageiro químico passa de uma célula para a outra, desencadeando uma resposta na célula alvo.
- Parácrina: o mensageiro químico é secretado e atua numa célula vizinha, se ligando a um receptor e desencadeando um mecanismo de transdução de sinal que reflete a resposta.
- Autócrina: o mensageiro químico secretado atua em um receptor presente na própria célula secretora.
- Endócrina: o mensageiro químico é chamado de hormônio, e pode migrar através da circulação sanguínea para tecidos distantes, atuando em células-alvo distantes do local de secreção. Os hormônios podem atuar em receptores na membrana da célula alvo ou ainda um receptor intracelular, desencadeando uma resposta.
- Neural: o mensageiro químico, chamado de neurotransmissor, é liberado na fenda sináptica para atuar sobre a célula alvo.
Tabela de comparação entre os sistemas de comunicação celular:
Na sinalização exócrina, moléculas sinalizadoras chamadas ferormônios são liberadas para o meio externo (ar, água) e se difundem pelo ambiente até alcançar sua célula alvo (ocorre em demarcação de território, cio etc).
A grande diferença entre os neurotransmissores e os hormônios está em como se dá o transporte desses mensageiros químicos. Enquanto os neurotransmissores são liberados na fenda sináptica (por isso, possuem um local de atuação mais restrito), os hormônios vão para a circulação sanguínea (por isso, ficam muito diluídas no sangue) e se direcionam para suas células-alvo.
 Devido à diluição dos hormônios na circulação sanguínea, acaba que o receptor para um neurotransmissor possui uma afinidade para esse sinalizador químico muito menor do que a afinidade dos receptores para hormônios, pois estes precisam ter afinidade muito maior para que o hormônio consiga se ligar à ele. Boa parte dos sinalizadores químicos hormonais são carreados por proteínas transportadoras específicas, e a especificidade/mecanismo de ação hormonal é dado pela presença ou não de um receptor específico na célula alvo, enquanto que a especificidade dos neurotransmissores é dada pela própria sinapse.
Devido à diluição dos hormônios na circulação sanguínea, acaba que o receptor para um neurotransmissor possui uma afinidade para esse sinalizador químico muito menor do que a afinidade dos receptores para hormônios, pois estes precisam ter afinidade muito maior para que o hormônio consiga se ligar à ele. Boa parte dos sinalizadores químicos hormonais são carreados por proteínas transportadoras específicas, e a especificidade/mecanismo de ação hormonal é dado pela presença ou não de um receptor específico na célula alvo, enquanto que a especificidade dos neurotransmissores é dada pela própria sinapse.
Dependendo da estrutura química do mensageiro, o mecanismo de ação desempenhado para que a célula dê a resposta será diferente. Sinalizadores químicos polares e apolares atuam através de diferentes mecanismos de sinalização. Isso ocorre porque as células estão separadas do meio extracelular pela membrana plasmática composta por uma bicamada de fosfolipídeos.
Dessa forma, moléculas polares terão mais dificuldade para atravessar a membrana, necessitando de receptores presentes na membrana. Já as moléculas apolares, por possuírem as mesmas propriedades da membrana celular, se difundem com mais facilidade.
Distinguem-se então dois mecanismos gerais de ação hormonal:
1. Hormônios hidrossolúveis: resposta rápida e curta.
2. Hormônios lipossolúveis: resposta lenta e duradoura.
Quando o hormônio se liga à membrana produzindo segundos mensageiros, como AMPc, isso desencadeia a modificação da atividade de enzimas pré-existentes, que já estão na célula. Isso gera uma resposta rápida e ao mesmo tempo curta, pois a alteração da atividade também pode ser modulada rapidamente.
Os sinalizadores que atuam através da modificação da quantidade de proteínas na célula designam uma resposta mais lenta e, em contrapartida, mais duradoura.
Para compreender melhor os mecanismos de ação hormonal, é interessante classificar os mensageiros quanto à sua natureza química. Exitem dois grandes grupos: os hormônios nitrogenados e os hormônios esteroides.
Dentre os hormônios nitrogenados, existem os hormônios amina, derivados do aminoácido tirosina. São compostos de pequeno peso molecular. Nesse grupo se incluem a adrenalina e a noradrenalina da medula adrenal, que são hidrossolúveis (polares), e os hormônios tireoidianos, menos solúveis em água (parcialmente apolares). Por serem parcialmente apolares, esses hormônios conseguem atravessar a membrana da célula e atuar em receptores intra-celulares, a nível de transcrição gênica.
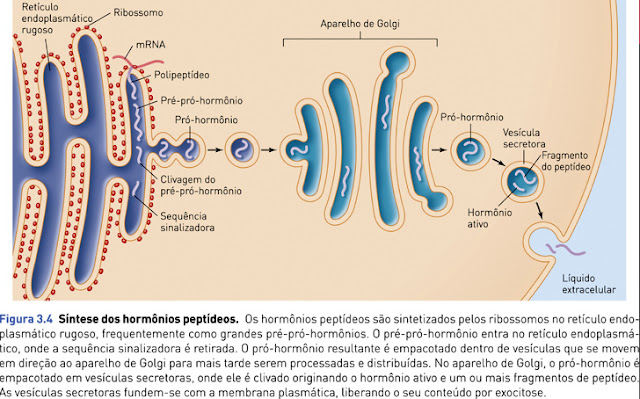
No grupo de hormônios nitrogenados existem também os hormônios peptídeos, que são compostos maiores (podem ter 3 a 200 aminoácidos) e incluem todos os hormônios do hipotálamo e da hipófise e os hormônios pancreáticos insulina, glucagon e somatostatina. Devido à sua natureza peptídica (proteica), esses hormônios são muito solúveis em água.
Hormônios de origem proteica podem ser armazenados dentro da célula em vesículas para serem secretados em determinada ocasião, diferente dos hormônios esteróides.
Os hormônios esteroides, diferente dos hormônios proteicos, são lipossolúveis, derivados do colesterol. Incluem os hormônios do córtex da adrenal (glicocorticóides e mineralcorticóides), as formas hormonais da vitamina D e os hormônios sexuais (andrógenos e estrógenos). Eles movimentam-se na corrente sanguínea ligados à proteínas específicas.
Mecanismos de transdução de sinal pelos quais os hormônios nitrogenados (polares - catecolaminas e proteínas) desencadeiam seus efeitos: Pela natureza proteica, esses hormônios necessitam de receptores na membrana da célula.
Existem três tipos principais de receptores de membrana:
1. Canais iônicos abertos por ligantes
2. Receptores associados à proteína G
3. Receptores de atividade enzimática (ex: receptor tirosina-quinase, que é o receptor para insulina, fatores de crescimento etc).
A maioria dos hormônios peptídicos têm seu mecanismo efetor através de receptores acoplados à proteína G, que quando ativada, se associa à uma enzima (proteína efetora) ou promove a abertura de um canal.
Receptores acoplados à proteína G (ou metabotrópicos):
Possuem um domínio extracelular que se associará ao mensageiro químico específico e um domínio citosólico com regiões associadas à proteína G e regiões que serão fosforiladas durante a dessensibilização do receptor.
Existem diferentes tipos de Receptores acoplados à proteína G:
1. Proteína G associada à Adenilil Ciclase (Gs)
2. Proteína G associada à Fosfolipase C (Gq)
3. Proteína G inibitória
4. Proteína G associada à Fosfodiesterase do GMPc
5. Proteína G estimulante de canais de potássio
6. Proteína G de neurônios olfatórios sensoriais
Esquema da Proteína G e seu ciclo de acordo com seu estado fisiológico:
A formação do complexo hormônio-receptor ativa a proteína G, trocando o GDP pelo GTP. Nesse momento a subunidade alfa da proteína G se desliga das subunidades beta e gama, e migra até sua proteína efetora, para então desencadear uma resposta.
Proteína Gs associada à ADENIL CICLASE:
Ativação da proteína quinase A (PKA):
A proteína quinase A é formada por duas subunidades reguladoras e duas subunidades catalíticas. O cAMP se liga às subunidades reguladoras, promovendo uma mudança de conformação e liberando as subunidades catalíticas da proteína. A subunidade catalítica é a que possui atividade quinase, ou seja, fosforila outras proteínas.

A fosforilação das outras proteínas celulares pela proteína quinase leva à resposta celular. Esse processo sofre amplificação, gerando uma cascata de fosforilação. A Adenil Ciclase produz o AMPc a partir do ATP. Para cada sinalizador químico que se liga ao receptor, uma molécula de Adenil Ciclase é ativada, produzindo 100 moléculas de AMPc, e cada AMPc ativa uma unidade catalítica da PKA. Cada PKA ativada pode fosforilar 100 unidades da PK (fosforilase quinase), tornando essa enzima mais ativa. A PK, por sua vez, fosforila cerca de 100 unidades da fosforilase do glicogênio, que consegue fosforilar cerca de 100 unidades do glicogênio liberando a glicose-1-fosfato. Ao final da cascata, então, há liberação de em torno de 100.000.000 de moléculas de glicose-1-fosfato a partir da ligação de um sinalizador químico ao seu receptor, caracterizando o processo de "amplificação de sinal".
Proteína Gq associada à FOSFOLIPASE C:
Exemplos de hormônios que atuam por esse mecanismo: TRH, LHRH, Ocitocina.
Receptores enzimáticos ou associados à enzimas:
Subdivididos em cinco classes:
1. Serina Treonina Quinases
2. Guanilato (ou Guanilil) Ciclase
3. Tirosina Quinases
4. Associados à tirosina quinases
5. Tirosina fosfatases
Receptor Guanilato ciclase:
Existem dois tipos de Guanilato Ciclase (isoenzimas) envolvidas na transdução de sinais: os de membrana, que são ativadas por seus ligantes celulares, e os solúveis, ativados pelo óxido nítrico intracelular (NO).
O primeiro (de membrana) tipo existe em duas formas semelhantes de posicionamento que são ativados por seus ligantes celulares: ANF e a endotoxina bacteriana. Esses receptores são isoenzimas envolvidas na transdução de sinal que envolve a síntese de GMPc.
Receptores Tirosina Quinase:
Existem 6 subfamílias dos receptores tirosina quinase, aos quais se ligam fatores de crescimento, insulina e outras moléculas.
Receptor de insulina:
Consiste em duas cadeias alfa localizadas na superfície externa da membrana plasmática e duas cadeias beta que atravessam a membrana e se estendem na face citosólica. A ligação da insulina nas cadeias alfa desencadeia a autofosforilação dos resíduos de Tirosina (Tyr) no domínio carboxiterminal das subunidades beta, que permite ao domínio da tirosina-quinase catalisar a fosforilação de outras proteínas-alvo.
Receptores Intracelulares:
Os hormônios apolares entram na célula alvo e encontram seu receptor no citoplasma, na membrana nuclear ou ainda dentro do núcleo, e ao se associarem aos seus receptores, estes têm sua conformação alterada, e passam a ter uma associação com algum gene, alterando o padrão da expressão gênica da célula. A transcrição e a tradução são alteradas, gerando como resposta a síntese (ou a inibição da síntese) de novas proteínas na célula.
Quando o hormônio se liga ao receptor em seu sítio de ligação, o receptor altera sua conformação. Nesse momento, um complexo proteico inibidor que estava obstruindo a região do receptor que se liga ao DNA se desassocia, e a região que se liga ao DNA fica exposta, podendo então interagir com o DNA.